Siarkowodór jest bezbarwnym gazem o zapachu przypominającym woń zgniłych jaj. W większych
stężeniach jest toksyczny. Jest to związek powstający w mało egzotermicznej reakcji. W procesie
tworzenia H2S wydziela się zaledwie 20,6 kJ/mol.
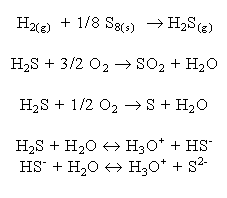 Siarkowodór wykazuje kątową budowę cząsteczki. Strukturę cząsteczek H2S
można w najprostszy sposób wyjaśnić przyjmując, że wiązania H-S są utworzone przez dwa
prostopadłe do siebie orbitale p atomu siarki o konfiguracji 1s22s22p
63s23p4. Siarkowodór wykazuje mały moment dipolowy z powodu
małej elektroujemności siarki. H2S nie może tworzyć wiązań wodorowych, dlatego w
stanie stałym nie uzyskuje luźnej struktury, lecz tworzy sieć cząsteczkową o gęstym ułożeniu.
W sieciach tych czynne są pomiędzy cząsteczkami tylko siły międzycząsteczkowe, słabsze od sił
powodujących powstanie wiązań wodorowych. Z tego powodu temperatura topnienia zespolonego
H2S jest dużo niższa od temperatury topnienia lodu (z wiązaniami wodorowymi). Podobnie
temperatura wrzenia słabo polarnego H2S jest niższa od temperatury wrzenia wody
(której cząsteczki wykazują dużą polarność). H2S spala się w powietrzu słabym niebieskawym
płomieniem, dając w przypadku dostatecznego dopływu tlenu dwutlenek siarki oraz parę wodną.
W przypadku niedostatecznego dopływu tlenu wydziela się siarka w stanie wolnym. Również wiele
innych środków utleniających jak chlorowce, nadtlenek wodoru, kwas azotowy (V), sole żelaza (III)
utleniają H2S do wolnej siarki lub dwutlenku siarki. Siarkowodór ma dość silne
właściwości redukujące. H2S rozpuszcza się w wodzie dość dobrze (w temp. 273K
rozpuszcza się 4,6 l/l wody). Jego roztwór wodny nosi nazwę wody siarkowodorowej i wykazuje
odczyn kwaśny. Jego dysocjacja przebiega dwustopniowo.
Siarkowodór wykazuje kątową budowę cząsteczki. Strukturę cząsteczek H2S
można w najprostszy sposób wyjaśnić przyjmując, że wiązania H-S są utworzone przez dwa
prostopadłe do siebie orbitale p atomu siarki o konfiguracji 1s22s22p
63s23p4. Siarkowodór wykazuje mały moment dipolowy z powodu
małej elektroujemności siarki. H2S nie może tworzyć wiązań wodorowych, dlatego w
stanie stałym nie uzyskuje luźnej struktury, lecz tworzy sieć cząsteczkową o gęstym ułożeniu.
W sieciach tych czynne są pomiędzy cząsteczkami tylko siły międzycząsteczkowe, słabsze od sił
powodujących powstanie wiązań wodorowych. Z tego powodu temperatura topnienia zespolonego
H2S jest dużo niższa od temperatury topnienia lodu (z wiązaniami wodorowymi). Podobnie
temperatura wrzenia słabo polarnego H2S jest niższa od temperatury wrzenia wody
(której cząsteczki wykazują dużą polarność). H2S spala się w powietrzu słabym niebieskawym
płomieniem, dając w przypadku dostatecznego dopływu tlenu dwutlenek siarki oraz parę wodną.
W przypadku niedostatecznego dopływu tlenu wydziela się siarka w stanie wolnym. Również wiele
innych środków utleniających jak chlorowce, nadtlenek wodoru, kwas azotowy (V), sole żelaza (III)
utleniają H2S do wolnej siarki lub dwutlenku siarki. Siarkowodór ma dość silne
właściwości redukujące. H2S rozpuszcza się w wodzie dość dobrze (w temp. 273K
rozpuszcza się 4,6 l/l wody). Jego roztwór wodny nosi nazwę wody siarkowodorowej i wykazuje
odczyn kwaśny. Jego dysocjacja przebiega dwustopniowo.
Siarkowodór jest wyraźnie słabszym kwasem niż wodorki fluorowców, mocniejszym jednak niż
wodorki azotowców, wykazujące raczej właściwości zasadowe.
 H2S jest najsłabszym kwasem z grupy H2X (najmocniejszym jest H2Te).
Można obliczyć, że w roztworze nasyconym pod ciśnieniem 105 Pa (tzn. o stężeniu 0,1 mol/dm3
) zaledwie jedna cząsteczka na tysiąc ulega rozpadowi na jon HS-, a na dziesięć
miliardów jonów HS- powstaje jeden jon S2-. Siarkowodór zachowuje się zatem
jak słaby kwas. Jony HS- zależnie od warunków przyłączają lub odszczepiają proton,
mogą zatem spełniać funkcję zarówno kwasu, jak i zasady. Jony S2- stanowiące
ostateczny produkt dysocjacji mogą pełnić tylko funkcję zasady.
H2S jest najsłabszym kwasem z grupy H2X (najmocniejszym jest H2Te).
Można obliczyć, że w roztworze nasyconym pod ciśnieniem 105 Pa (tzn. o stężeniu 0,1 mol/dm3
) zaledwie jedna cząsteczka na tysiąc ulega rozpadowi na jon HS-, a na dziesięć
miliardów jonów HS- powstaje jeden jon S2-. Siarkowodór zachowuje się zatem
jak słaby kwas. Jony HS- zależnie od warunków przyłączają lub odszczepiają proton,
mogą zatem spełniać funkcję zarówno kwasu, jak i zasady. Jony S2- stanowiące
ostateczny produkt dysocjacji mogą pełnić tylko funkcję zasady.
Pochodną H2S są siarczki powstałe przez zastąpienie atomów wodoru
metalem. Siarczki w wyniku małej elektroujemności odznaczają się w większości kowalencyjnym
charakterem wiązań.
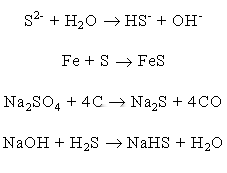 Siarczki o wiązaniach, w których charakter jonowy przeważa nad kowalencyjnym są tworzone
wyłącznie przez metale o najmniejszej elektroujemności (litowce, berylowce). Siarczki litowców
są w wodzie dobrze rozpuszczalne. Ulegają one silnej hydrolizie. Siarczki berylowców są na ogół
słabo rozpuszczalne w wodzie. W zetknięciu z wodą ulegają jednak hydrolizie z utworzeniem dobrze
rozpuszczalnych wodorosiarczków. Siarczki metali ciężkich są w wodzie trudno rozpuszczalne, a
wiele spośród nich nie ulega nawet działaniu mocnych kwasów. Siarczki te można otrzymać przez
nasycenie siarkowodorem roztworu soli odpowiedniego metalu. Siarczki metali ciężkich można także
otrzymać przez bezpośrednią syntezę z pierwiastków w podwyższonych temperaturach, oraz przez
reakcję siarczanów podczas ogrzewania ich z węglem. Wodorosiarczki metali alkalicznych uzyskuje
się nasycając siarkowodorem roztwór odpowiedniego wodorotlenku.
Siarczki o wiązaniach, w których charakter jonowy przeważa nad kowalencyjnym są tworzone
wyłącznie przez metale o najmniejszej elektroujemności (litowce, berylowce). Siarczki litowców
są w wodzie dobrze rozpuszczalne. Ulegają one silnej hydrolizie. Siarczki berylowców są na ogół
słabo rozpuszczalne w wodzie. W zetknięciu z wodą ulegają jednak hydrolizie z utworzeniem dobrze
rozpuszczalnych wodorosiarczków. Siarczki metali ciężkich są w wodzie trudno rozpuszczalne, a
wiele spośród nich nie ulega nawet działaniu mocnych kwasów. Siarczki te można otrzymać przez
nasycenie siarkowodorem roztworu soli odpowiedniego metalu. Siarczki metali ciężkich można także
otrzymać przez bezpośrednią syntezę z pierwiastków w podwyższonych temperaturach, oraz przez
reakcję siarczanów podczas ogrzewania ich z węglem. Wodorosiarczki metali alkalicznych uzyskuje
się nasycając siarkowodorem roztwór odpowiedniego wodorotlenku.
Według nomenklatury przyjętej przez Międzynarodową Unię Chemii Czystej i Stosowanej nazwę lotnych wodorochlorków, z wyjątkiem wodorków pierwiastków grupy VII oraz tlenu i azotu, tworzy się dodając końcówkę -an do rdzenia pierwiastka. Odpowiednio do tego międzynarodowa nazwa siarkowodoru brzmi sulfan.