Siarkowodór jest jedyną substancją z grupy H2S (oprócz H2O)
występującą w stanie wolnym w przyrodzie. Występuje on głównie w źródłach siarczanowych,
wyziewach wulkanicznych, niektórych gatunkach ropy naftowej i gazu ziemnego. Pojawia się także w
produktach rozkładu białek. Siarkowodór powstaje również w procesach rozkładu gnilnego związków
organicznych, dlatego w dużych stężeniach może występować w kanałach, dołach kloacznych, ściekach,
zbiornikach odpadowych. W laboratorium H2S otrzymywany jest zazwyczaj w
aparacie Kippa w wyniku działania kwasem solnym na siarczek żelaza (II).
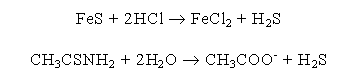 Zawiera on często zanieczyszczenia wodorem, ponieważ handlowy FeS otrzymywany jest przez stapianie
siarki z opiłkami żelaza i zawiera zwykle nieco nieprzereagowanego żelaza, wydzielającego wodór z
kwasu solnego. H2S powstaje także podczas hydrolizy amidu kwasu tiooctowego
w środowisku kwaśnym lub zasadowym (własność ta wykorzystywana jest podczas oznaczania kationów
grupy III i IV (siarkowodór w chwili powstania wytrąca charakterystyczne osady właściwych siarczków).
Zawiera on często zanieczyszczenia wodorem, ponieważ handlowy FeS otrzymywany jest przez stapianie
siarki z opiłkami żelaza i zawiera zwykle nieco nieprzereagowanego żelaza, wydzielającego wodór z
kwasu solnego. H2S powstaje także podczas hydrolizy amidu kwasu tiooctowego
w środowisku kwaśnym lub zasadowym (własność ta wykorzystywana jest podczas oznaczania kationów
grupy III i IV (siarkowodór w chwili powstania wytrąca charakterystyczne osady właściwych siarczków).
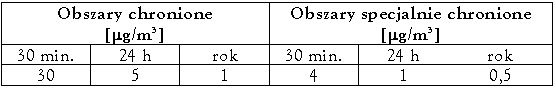
Najwyższe dopuszczalne stężenie w środowisku pracy wynosi 10 mg/l, a chwilowe 20 mg/l.
 Siarkowodór wchłania się łatwo przez płuca a jedynie w małym stopniu przez skórę. Wydala się
częściowo w postaci nie zmienionej przez płuca, a także, po utlenieniu w organizmie do kwasu
siarkowego, wydala się z moczem w postaci wolnych lub sprzężonych siarczanów. Część H2S
rozkłada się we krwi i tkankach z wydzieleniem siarki, która z nierozłożonym siarkowodorem tworzy
wielosiarczki.
Siarkowodór wchłania się łatwo przez płuca a jedynie w małym stopniu przez skórę. Wydala się
częściowo w postaci nie zmienionej przez płuca, a także, po utlenieniu w organizmie do kwasu
siarkowego, wydala się z moczem w postaci wolnych lub sprzężonych siarczanów. Część H2S
rozkłada się we krwi i tkankach z wydzieleniem siarki, która z nierozłożonym siarkowodorem tworzy
wielosiarczki.